Le riduzioni nelle reazioni organiche si verificano quando viene addizionato idrogeno o rimosso ossigeno o ambedue i processi insieme. Ad esempio l’idrogenazione, reazione che prevede l’addizione di idrogeno a legami multipli, è una riduzione.
Agenti riducenti usati nelle riduzioni
I più comuni agenti riducenti della chimica organica possono essere classificati in:
Catalizzatori come Pd, Pt e Ni
Idruri: LiAlH4, AlH3, NaBH4, BH3, R2BH, C6H5SnH
Metalli: Li, Na, K, Zn, Mg
Altri: NH2NH2, R3P, SO32-, SnCl2, FeCl2
Le riduzioni sono quindi effettuate da reagenti che cedono elettroni.
Idrogenazione catalitica di un alchene

Nella reazione il primo carbonio passa da numero di ossidazione -1 a numero di ossidazione -2, mentre il secondo carbonio passa da numero di ossidazione -2 a numero di ossidazione -3; aumenta da tre a cinque il numero di legami carbonio idrogeno.
Reazione del sodio boroidruro con un chetone
Nella reazione:
- il secondo carbonio passa da numero di ossidazione +2 a numero di ossidazione zero
- aumenta il numero di legami tra carbonio e idrogeno (da zero a uno)
- diminuisce il numero di legami tra carbonio e ossigeno ( da due a uno).

Tra le due riduzioni considerate nel primo caso è stato adoperato un metallo per catalizzare la reazione tra idrogeno gassoso e il doppio legame carbonio – carbonio presente nell’alchene. Nel secondo caso è stata adoperata una fonte di ioni idruro per ridurre il doppio legame carbonio ossigeno.
L’idrogenazione fa uso di un reagente non polare per ridurre il doppio legame a sua volta non polare. Gli atomi sulla superficie del metallo sono diversi da quelli che si trovano all’interno in quanto essi non possono formare forti legami metallici.
In presenza di un catalizzatore metallico si rompe il legame idrogeno-idrogeno e ciascun idrogeno si lega alla superficie del catalizzatore formando un legame metallo-idrogeno.

Un atomo di idrogeno viene quindi trasferito all’alchene formando un nuovo legame carbonio-idrogeno. Un secondo atomo di idrogeno forma un altro legame carbonio-idrogeno. A questo punto due atomi di idrogeno si sono addizionati al doppio legame dando luogo a una addizione syn.
La regioselettività dell’addizione non può essere rilevata quando si ottiene un alcano in quanto la libera rotazione intorno al legame semplice non ci consente di avere informazioni.
La riduzione di un cicloalchene quale l’1,2-dimetil,1-cicloesene, invece, che dà, come prodotto di reazione il cis-1,2-dimetilcicloesano ci consente di confermare la stereospecificità della reazione.
Sodio boroidruro
Il sodio boroidruro non reagisce con il doppio legame carbonio-carbonio, ma agisce fornendo lo ione idruro che è un forte nucleofilo e una forte base di Brønsted-Lowry. Lo ione H– attacca il gruppo carbonilico che è un gruppo polare di un’aldeide o di un chetone.
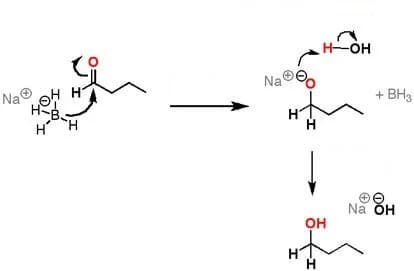
Lo ione BH4– dà BH3 e H–; quest’ultimo che agisce da nucleofilo attacca il gruppo carbonilico che ha una parziale carica positiva formando con esso un legame carbonio-idrogeno. Si rompe conseguentemente il doppio legame carbonio ossigeno e quest’ultimo assume una carica negativa (formazione dell’alcossido). Nello stadio successivo lo ione ossigeno attacca una molecola di acqua prendendo da essa uno ione H+ dando così un alcol e e uno ione OH–
