Le reazioni di riduzione dei composti organici possono essere classificate in quattro grandi categorie
Essenzialmente i tipi di reazioni di riduzione sono:
1) idrogenazione catalitica
3) Riduzione con metalli
4) Riduzione con altri riducenti
Molti dei gruppi funzionali che caratterizzano le classi dei composti organici possono essere ridotti da diversi reagenti riducenti con maggiore o minore facilità. Inoltre, lo stesso riducente, usato in diverse condizioni, può modificare fortemente il suo potere riducente. Pertanto, selezionando i diversi riducenti o semplicemente variando le condizioni di reazione, si può effettuare la riduzione di un solo gruppo in molecole con più funzioni riducibili, lasciando inalterati gli altri gruppi.
In questa sezione verranno esaminati le prime due tipologie di reazioni di riduzione
Reazioni di riduzione
Idrogenazione catalitica
La maggior parte dei composti contenenti legami multipli C-C e C-eteroatomo, addiziona idrogeno e si trasforma in composti a più basso numero di ossidazione. L’addizione di idrogeno, inoltre, può generare in alcuni substrati contenenti un legame C-eteroatomo la rottura di questo legame con formazione di un legame C-H (idrogenolisi).
L’idrogenazione catalitica che è una delle reazioni di riduzione più note si realizza con idrogeno in presenza di catalizzatori metallici. In prevalenza si tratta di metalli di transizione o di loro composti.
Fra i più usati: Nichel Raney, ossido di platino, rodio, rutenio, palladio su carbone.

L’idrogenazione può avvenire a pressione atmosferica o sotto pressione, a temperatura ambiente o a caldo e viene seguita misurando il consumo di idrogeno.
Il meccanismo di reazione prevede l’attivazione dell’idrogeno sulla superficie del catalizzatore che successivamente viene ceduto agli elettroni π del substrato organico. L’addizione è di tipo cis e avviene dalla parte meno impedita del legame multiplo.
Riduzione con idruri
Alcuni idruri complessi quali quello di litio e alluminio o di sodio e boro (LiAlH4 , NaBH4) hanno la capacità di cedere ioni idruro H–. Lo ione idruro si comporta da nucleofilo e come tale può dar luogo a reazioni di sostituzione e di addizione nucleofila.
Reazioni di sostituzione nucleofila al carbonio sp3
I substrati sensibili all’azione degli idruri sono quei composti capaci di subire la sostituzione nucleofila al carbonio saturo. L’azione del LiAlH4 può essere così schematizzata:
Li+Al–H4 + R-X → Li+AlH3 + R-H + X–
In particolare gli alogenuri alchilici formano legami C-H per spostamento con idruri.
Reazioni di addizione nucleofila al carbonile
L’atomo di carbonio del carbonile è un elettrondeficiente e può addizionare ioni idruro trasformandosi in carbonio tetraedrico.
Sono sensibili all’azione del LiAlH4 molti composti carbonilici quali aldeidi, chetoni, acidi carbossilici, esteri, ammidi ecc.
Addizione di borani
Addizione di borani al legame multiplo C-C. L’attacco iniziale del boro procede in modo che si formi il carbocatione più stabile e in modo che l’idrogeno sia in posizione cis rispetto al boro: il processo, tuttavia, non si arresta a questo primo stadio e l’alchilborano che si forma reagisce con una seconda molecola di alchene e poi con una terza fino alla formazione del trialchilborano
Addizione di borani al legame multiplo C-eteroatomo. Il diborano riduce le aldeidi e i chetoni addizionandosi al carbonile in modo che il boro si leghi all’ossigeno e l’idrogeno al carbonio:
R2C=O + B2H6 → (R2HC-O–)3B → R2HC-OH
Reazioni con trasferimento di idruri
Un certo numero di reazioni di riduzione avviene mediante trasferimento di uno ione idruro da un atomo di carbonio a un altro capace di accettarlo.
Sono esempi di questo tipo di reazioni la reazione di Cannizzaro dovuta al chimico italiano Stanislao Cannizzaro e quella di Leuckart e la riduzione di Meerwein-Ponndorf-Verley
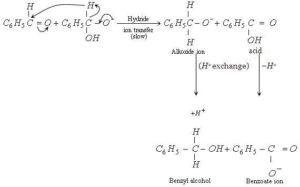
Reazione di Cannizzaro. Aldeidi aromatiche o aldeidi alifatiche che non hanno nessun idrogeno in α al carbonile subiscono una reazione di di sproporzione in presenza di basi forti trasformandosi in alcol e acido carbossilico:
2 RCHO + KOH→ RCH2OH + RCOO–K+
Il meccanismo di questa reazione prevede tre stadi:
1) Attacco nucleofilo iniziale dello ione OH– al carbonile
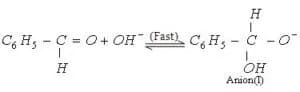
2) Transfer di uno ione idruro ad un’altra molecola di aldeide: quest’ultima viene ridotta allo ione alcossido mentre la prima è ossidata ad acido
3) Trasferimento di un protone con ottenimento dello ione carbossilato RCOO– e di un alcol RCH2OH
Reazione di Leuckart. Aldeidi e chetoni reagiscono a caldo con formiato di ammonio trasformandosi in ammine primarie:
R2C=O + HCOONH4 → R2CHNH2
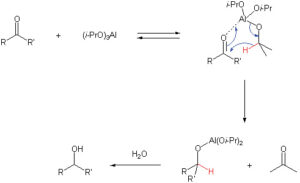
Riduzione di Meerwein-Ponndorf-Verley.
Aldeidi e chetoni in presenza di alcolati di alluminio si riducono ad alcoli primari e secondari. Questa reazione si svolge in tre stadi: 1) coordinazione del carbonile con l’alcossido; 2) trasferimento di idruro dall’alcossido; 3) separazione del nuovo composto formatosi.