Gli acidi bicarbossilici sono composti polifunzionali contenenti due funzioni carbossiliche e sono di notevole interesse per le proprietà che la posizione reciproca dei due carbossili può conferire alla molecola.
Nomenclatura degli acidi bicarbossilici
I nomi più comunemente usati per gli acidi bicarbossilici sono:
1) Nomi sistematici (IUPAC). Il nome viene derivato dall’idrocarburo contenente lo stesso numero di atomi di carbonio, comprese le due funzioni carbossiliche, e sostituendo l’ultima lettera del suffisso dell’idrocarburo con –dioico.
2) Nomi comuni. Molto spesso alla denominazione sistematica si preferiscono nomi comuni: una frase inglese permette di ricordare le iniziali dei primi sei acidi ossalico, malonico, succinico, glutarico, adipico, pimelico, Oh, my such good apple pie che in italiano si può traslare: ohimè, mangio solo gelati al pistacchio.
In tabella vengono riportati, accanto ai nomi IUPAC, quelli comuni di alcuni acidi bicarbossilici
| Formula | Nome IUPAC | Nome comune |
| HOOC-COOH | Acido etandioico | Acido ossalico |
| HOOC-CH2– COOH | Acido propandioico | Acido malonico |
| HOOC-CH2– CH2– COOH | Acido butandioico | Acido succinico |
| HOOC-CH2– CH2-CH2– COOH | Acido pentandioico | Acido glutarico |
| HOOC-CH2– CH2– CH2-CH2– COOH | Acido esandioico | Acido adipico |
| HOOC-(CH2)5-COOH | Acido eptandioico | Acido pimelico |
| HOOC-(CH2)6-COOH | Acido ottandioico | Acido suberico |
| HOOC-(CH2)7-COOH | Acido nonandioico | Acido azelaico |
| HOOC-(CH2)8-COOH | Acido decandioico | Acido sebacico |
| HOOC-CH=CH-COOH (cis) | Acido butandioico (cis) | Acido maleico |
| HOOC-CH=CH-COOH (trans) | Acido butandioico (trans) | Acido fumarico |
Proprietà fisiche
Gli acidi bicarbossilici presentano le caratteristiche fisiche dei composti contenenti funzioni fortemente polari. Sono dei solidi i cui termini inferiori sono solubili in acqua e in solventi polari.
La presenza di due funzioni carbossiliche dà luogo a due equilibri di dissociazione acida caratterizzati da due costanti Ka1 e Ka2:
HOOC-(CH2)n-COOH ⇄ HOOC-(CH2)n-COO– + H+ Ka1
HOOC-(CH2)n-COO– ⇄ – OOC-(CH2)n-COO– + H+ Ka2
L’effetto induttivo di un carbossile intensifica l’acidità dell’altro e, per quello che concerne la prima costante di dissociazione la forza degli acidi bicarbossilici è maggiore di quella dell’acido acetico, anche se essa diminuisce all’aumentare della distanza dei due gruppi carbossilici.
Metodi di sintesi degli acidi bicarbossilici
L’acido ossalico viene ottenuto per riscaldamento ad alte temperature dei sali alcalini dell’acido formico e successiva idrolisi:
2 HCOO– M+→ H2 + NaOOC-COONa → HOOC-COOH
L’acido malonico si ottiene per sostituzione nucleofila dell’acido cloroacetico con ioni cianuro e successive idrolisi:
Cl-CH2-COOH + NaOH → Cl-CH2-COO–Na+ + H2O
Cl-CH2-COO–Na+ + CN– → NC- CH2-COO–Na+ (cianoacetato di sodio)+ NaCl
NC- CH2-COO–Na+ + H2O → HOOC-CH2-COOH
Una sintesi molto usata per ottenere l’acido succinico è l’addizione di acetilene alla formaldeide in presenza di sali di rame (I) e di cloruro di ammonio:
HC≡CH + 2 CH2O → HOCH2-C≡C-CH2OH ( 1,4- butindiolo)
Quest’ultimo per riduzione dà l’1,4-butandiolo HOCH2-CH2– CH2 -CH2OH che, a seguito di reazione con permanganato di potassio in ambiente basico dà l’acido succinico HOOC-CH2– CH2– COOH.
Reattività degli acidi bicarbossilici
Gli acidi bicarbossilici danno le stesse reazioni caratteristiche della funzione carbossile. Interessante è il comportamento degli acidi bicarbossilici in alcune reazioni in cui la presenza del secondo carbossile conferisce alla molecola un comportamento particolare.
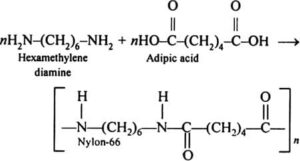
1) Polimerizzazione per condensazione: l’utilizzazione di reattivi bifunzionali permette la contemporanea reazione dei due gruppi carbossilici con formazione di derivati funzionali di natura polimerica. Ne è un esempio la sintesi del nylon 6,6 (una poliammide) per reazione dell’acido adipico con esametilendiammina:
2) Bisdecarbossilazione: l’acido succinico e i suoi alchil e aril derivati per reazione con tetraacetato di piombo perdono due molecole di biossido di carbonio dando alcheni. La reazione è stereoselettiva attraverso un meccanismo concertato.
