Le reazioni endotermiche sono quelle reazioni che avvengono con assorbimento di calore per le quali la variazione di entalpia è maggiore di zero.
In una reazione chimica si verifica il passaggio da reagenti a prodotti di reazione. In tale conversione si rompono i legami presenti nei reagenti e si formano nuovi legami nei prodotti.
Tutti i legami chimici hanno una energia di legame e necessitano di una determinata energia per potersi rompere. Quest’ultima è fornita dalla collisione tra i reagenti o da un riscaldamento esterno; analogamente la formazione di legami chimici comporta l’emissione di energia.
La variazione complessiva di energia durante una reazione chimica, detta calore di reazione è indicata con ΔH ed è espressa in genere in kJ/mol.
A seconda della variazione di energia che si verifica le reazioni chimiche sono classificate in reazioni esotermiche e reazioni endotermiche.
Nelle reazioni esotermiche l’energia è fornita sotto forma di calore; l’energia del prodotti Hp è quindi minore rispetto a quella dei reagenti Hr e quindi la variazione di energia, più nota come variazione di entalpia ΔH è minore di zero in quanto ΔH = Hp – Hr. Un esempio di reazione esotermica è la combustione in cui l’energia è emessa sotto forma di calore.
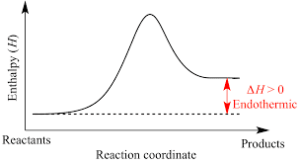
Nelle reazioni endotermiche è assorbita energia sotto forma di calore che serve per rompere i legami presenti nei reagenti ed è rilasciata quando si formano i nuovi legami chimici nei prodotti. L’energia assorbita risulta maggiore di quella fornita e i prodotti di una reazione endotermica hanno un’energia superiore rispetto a quella dei reagenti ovvero Hp > Hr e quindi ΔH = Hp > Hr > 0.
A livello molecolare l’energia cinetica si trasforma in energia potenziale con una diminuzione della temperatura del sistema. L’energia potenziale dei prodotti è maggiore rispetto a quella dei reagenti.
Esempi di reazioni endotermiche
Ad esempio, se viene messa in acqua una certa quantità di cloruro di ammonio o di tiosolfato di sodio il recipiente, dopo che è avvenuta la dissoluzione, diventa più freddo.
La reazione tra azoto e ossigeno che dà, come prodotto di reazione il monossido di azoto avviene con assorbimento di calore e la reazione può essere espressa come:
N2(g) + O2(g) + 180 kJ → 2 NO
oppure come: N2(g) + O2(g) → 2 NO ΔH = – 180 kJ
Nella molecola di azoto gli atomi sono legati con un triplo legame e l’energia necessaria per romperlo è maggiore rispetto a quella fornita dalla formazione del monossido di azoto.
Altri esempi di reazioni endotermiche sono costituiti dalla sintesi del solfuro di carbonio a partire da carbonio e zolfo e dalla reazione tra diossido di stagno e carbonio:
C(s) + 2 S(s) → CS2(g) ΔH = + 92.0 kJ
SnO2(g) + 2 C(s) → Sn(s) + 2 CO2(g) ΔH = + 360 kJ
Le reazioni endotermiche possono avvenire a temperatura ambiente se vi è un notevole incremento di entropia. Si consideri, ad esempio, la reazione dell’idrossido di bario ottaidrato con il tiocianato di ammonio:
Ba(OH)2 · 8 H2O(l) + 2 NH4SCN(s) → Ba(SCN)2(s) + 10 H2O(l) + 2 NH3(g)
Questa reazione è altamente endotermica e, poiché 3 molecole di solido ( una dell’idrossido e due del tiocianato) reagiscono per produrre complessivamente 13 molecole di cui 10 sono liquide e 2 gassose, si verifica un aumento notevole dell’entropia che rende possibile la reazione.
L’esempio più emblematico di reazione endotermica è costituito dalla fotosintesi clorofilliana in cui il diossido di carbonio e l’acqua danno, come prodotto di reazione il glucosio:
6 CO2(g) + 6 H2O(l) → C6H12O6(s) + 6 O2(g) ΔH = + 2.80 · 103 kJ/mol di glucosio
La fonte di energia affinché possa avvenire la reazione è l’energia radiante emessa dal sole. Nel processo di fotosintesi l’energia solare viene sfruttata per ottenere il glucosio.
Numerose reazioni endotermiche sono importanti per il metabolismo dei mammiferi e molte di esse si verificano all’interno delle cellule e sono dette reazioni anaboliche, in contrapposizione alle reazioni cataboliche, che rilasciano energia. Alcune di queste reazioni includono:
- Amminoacidi che si uniscono per formare peptidi.
- Piccole molecole di zucchero che si uniscono per formare disaccaridi.
- Il glicerolo reagisce con gli acidi grassi per produrre lipidi
