Il fosforo si presenta in diverse forme allotropiche ed è presente in natura come fosfato di calcio Ca3(PO4)2 in giacimenti di fosforiti dove il fosforo è presente come fluorapatite Ca5(PO4)3F e apatiti.
I fosfati sono anche costituenti importanti delle ossa.
Ottenimento
Il fosforo si ottiene per riduzione dei fosfati con carbone in presenza di sabbia:
2 Ca3(PO4)2 + 10 C + 6 SiO2 → P4 + 6 CaSiO3 + 10 CO
Il fosforo, data l’elevata temperatura che si raggiunge nella reazione, distilla e viene raccolto in acqua sotto forma di fosforo bianco che ha consistenza cerosa e formula molecolare P4 a geometria tetraedrica.
Il fosforo bianco è tristemente famoso dal momento che, a contatto con l’ossigeno presente nell’aria, produce anidride fosforica che reagisce violentemente con i composti contenenti acqua come i tessuti e li disidrata producendo acido fosforico secondo le seguenti reazioni
P4 + O2 → 2 P2O5
P2O5 + 3 H2O → 2 H3PO4
Il calore sviluppata dalla reazione brucia la restante parte del tessuto molle con conseguente distruzione del tessuto organico. Le bombe incendiarie al fosforo, che secondo le convenzioni internazionali possono essere utilizzate solo a scopo di illuminazione, vengono purtroppo adoperate come arma chimica di distruzione di massa.
Il fosforo bianco è talmente reattivo e ossidabile all’aria che va tenuto e manipolato sotto acqua oltre ad essere molto tossico.
Stato naturale, preparazione e proprietà.
Oltre che nella forma allotropica fosforo bianco, l’elemento si presenta anche sotto forma di fosforo rosso e fosforo nero. Il fosforo rosso si ottiene scaldando quello bianco per qualche ora in presenza di iodio; si ritiene che la molecola sia costituita da un polimero derivato dal P4.
La forma allotropica rossa è molto meno reattiva di quella bianca. Il fosforo nero si ottiene scaldando a lungo quello bianco a 200-400 °C e sotto alte pressioni. La sua struttura consiste in un impacchettamento di piani molecolari corrugati in cui ogni atomo è tricoordinato. Il fosforo nero ha un aspetto metallico, conduce l’elettricità ed ha sfaldatura tipo grafite: è la forma allotropica meno reattiva delle tre specie.
Composti
Ossidi
I principali ossidi del fosforo sono il triossido e il pentossido le cui formule molecolari sono P4O6 e P4O10 rispettivamente.
Il triossido di fosforo è il prodotto principale della combustione del fosforo in difetto di ossigeno. E’ un composto volatile ( temperatura di fusione 23.9 °C) la cui struttura molecolare contiene ancora il tetraedro P4 con gli ossigeni legati a ponte su sei spigoli. E’ abbastanza reattivo e scaldato all’aria dà il pentossido. Trattato con acqua a freddo dà l’acido fosforoso di cui è l’anidride mentre se è trattato con acido cloridrico dà acido fosforoso e tricloruro di fosforo. Il comportamento descritto è schematizzabile come segue:
P2O3 + O2 → P2O5
L’ossido di fosforo (III) reagisce con l’acqua per dare acido fosforoso
P2O3 + 3 H2O → 2 H3PO3
P2O3 + 3 HCl → H3PO3 + PCl3
Il pentossido di fosforo si ottiene bruciando l’elemento in eccesso di aria. E’ un solido bianco che sublima a 360°C ; una delle principali proprietà chimiche del pentossido di fosforo è la sua igroscopicità: reagisce infatti prontamente con l’acqua per dare acidi fosforici. Per questa sua proprietà viene usato come forte agente essiccante e come disidratante in numerose reazioni chimiche. Per fusione con ossidi basici dà fosfati.
Sono noti anche ossidi a composizione intermedia tra i due principali: P4O7, P4O8 e P4O9.
Il fosforo dà svariati ossiacidi in cui esso è sempre tetracoordinato con geometria tetraedrica.
Ossiacidi
L’acido ipofosforoso H3PO2 è un acido monobasico piuttosto forte ( Ka = 8∙10-2) . la sua natura è spiegata dalla formula di struttura:
in cui si nota che l’unico atomo di idrogeno ionizzabile, come in tutti gli ossiacidi è quello legato all’ossigeno.
L’acido ipofosforoso si può ottenere per ossidazione della fosfina con iodio in acqua:
PH3 + 2 I2 + 2 H2O → H3PO2 + 4 HI
I suoi sali si ottengono per idrolisi alcalina del fosforo:
P4 + 4 OH– + 4 H2O → 4 H2PO2– + 2 H2
Sia l’acido che i suoi sali sono energici agenti riducenti perché tendono a dare fosfati.
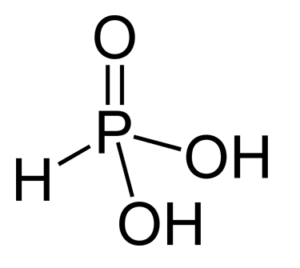
L’acido fosforoso H3PO3 è un acido bibasico e si ottiene tramite idratazione a freddo di P2O3 , per idrolisi di PCl3 o per dismutazione alcalina del fosforo (in questo caso si ottiene l’anione fosfito):
PCl3 + 3 H2O → H3PO3 + 3 HCl
P4 + 4 OH– + 2 H2O → 2 HPO32- + 2 PH3
La formula di struttura è la seguente:
Può essere facilmente ossidato ad acido fosforico e dà due serie di sali: gli idrogenofosfiti e i fosfiti per la maggior parte insolubili ad eccezione di quelli alcalini e del calcio.
Il più importante acido del fosforo è l’acido ortofosforico H3PO4 che è tribasico ed ha la seguente formula di struttura:
si ottiene per idratazione del pentossido o direttamente dalle fosforiti per trattamento con acido solforico:
P4O10 + 6 H2O → 4 H3PO4
2 Ca3(PO4)3 + 6 H2SO4 + 12 H2O → 4 H3PO4 + 6 CaSO4∙ 2 H2O
L’acido ortofosforico dà tre serie di sali del tipo NaH2PO4, Na2HPO4, Na3PO4 a seconda che venga sostituito rispettivamente uno, due o tre atomi di idrogeno. Quasi tutti i fosfati sono insolubili eccetto quelli alcalini e diidrogenofosfati alcalino-terrosi. Si dissolvono in acidi forti perché ha luogo lo spostamento di H3PO4 meno forte. Fra i fosfati quello di calcio Ca(H2PO4)2 e di ammonio (NH4)2HPO4 sono usati come fertilizzanti.
Per riscaldamento di H3PO4 si ottiene l’acido pirofosforico H4P2O7: i suoi sali, i pirofosfati si ottengono disidratando i monoidrogenofosfati:
2 H3PO4 → H4P2O7 + H2O
2 Na2HPO4 → Na4P2O7 + H2O
La struttura molecolare dell’anione pirofosfato consiste di due tetraedri con un vertice in comune .
Esiste un gran numero di acidi polifosforici e dei corrispondenti anioni contenenti ponti del tipo P-O-P ; alcuni di essi hanno struttura lineare, estensione di quella del pirofosfato. La loro formula generale risulta quindi (PnO3n+1)(n+2)-
La struttura dell’anione pirofosfato e trifosfato sono riportate in figura:
Alogenuri, idruri e altri composti
Sono noti tutti i trialogenuri PX3; dei pentalogenuri sono noti soltanto PF5, PCl5 e PBr5. Esistono anche i tetralogenuri P2F4, P2Cl4 e P2I4.
Dei trialogenuri sono importanti solo PF3 e ancor più PCl3 ; quest’ultimo viene usato per preparare idroliticamente acido fosforoso per reazione con acqua.
I pentalogenuri hanno, allo stato di vapore, struttura bipiramidale trigonale, mentre allo stato solido PCl5 e PI5 hanno strutture ioniche con cationi PX4+ e anioni PX6–. Anche PF5 ha una grande tendenza a coordinare uno ione F– dando l’anione esafluorofosfato [PF6]– assai stabile anche in acqua. I pentalogenuri si idrolizzano violentemente in acqua:
PCl5 + 4 H2O → H3PO4 + 5 HCl
Il fosforo dà due idruri: la fosfina PH3 e la difosfina P2H4. La fosfina è analoga all’ammoniaca, è tossica e si ottiene per dismutazione del fosforo in soluzioni alcaline o per idrolisi dei fosfuri metallici:
Ca3P2 + 6 H2O → 3 Ca(OH)2 + 2 PH3
Si ossida facilmente all’aria ed è poco solubile in acqua. Reagisce con alcuni acidi dando sali di fosfonio come PH4I. Lo ione PH4+ è instabile e i suoi sali si decompongono facilmente in acqua:
PH4I + H2O → H3O+ + I– + PH3
La difosfina P2H4 si forma spesso insieme alla fosfina; è un liquido volatile, giallo e instabile, si infiamma facilmente all’aria e tende a polimerizzare.
Il fosforo si combina con i metalli dando fosfuri con varie stechiometrie e con proprietà chimico-strutturali molto diverse. I fosfuri con gli elementi più elettropositivi si possono considerare ionici, contenendo, almeno formalmente, lo ione P3-. I fosfuri con i metalli di transizione sono composti interstiziali e sono più resistenti e meno reattivi.
Sono anche importanti i composti del fosforo con elementi non metallici, in particolare con lo zolfo. Tra i solfuri si ricordano: P4S3, P4S5, P4S7, P4S10. Tutti si ottengono per sintesi dagli elementi e, trattandosi di solidi molecolari si sciolgono in solventi organici come solfuro di carbonio, benzene ecc. P4S3 è usato nella confezione di fiammiferi.
Il fosforo dà composti ternari contenenti azoto e alogeni, i cosiddetti alogenuri di fosfonitrile, la cui formula minima è del tipo PNX2. Di questi si conoscono monomeri, dimeri, polimeri ciclici e polimeri lineari.