Il fosforo come alcuni elementi appartenenti prevalentemente dei Gruppi 13, 14, 15 e 16 della Tavola Periodica possono presentarsi in diverse forme allotropiche . Esse differiscono tra loro per le proprietà fisiche e chimiche oltre che per la forma cristallina pur presentando lo stesso stato di aggregazione.
Le forme allotropiche più comuni del fosforo sono il fosforo:
- bianco
- rosso
- nero
Fosforo bianco
E’ la forma allotropica più comune e si presenta ceroso e translucido diventando giallo quando è esposto alla luce. Emette luce verde al buio e mostra quindi chemiluminescenza, è infiammabile e piroforico. E’ costituito da una struttura tetraedrica ai cui vertici sono posizionati gli atomi dell’elemento. Pertanto ha una struttura P4 che è presente sia allo stato liquido che gassoso fino alla temperatura di 800°C quando si decompone in difosforo P2.
Esiste in due forme cristalline: la forma α con struttura cubica a corpo centrato che a – 76.9°C si trasforma nella forma β che si ritiene abbia una struttura esagonale.
È insolubile in acqua ma solubile in solfuro di carbonio e in tetracloruro di carbonio e si solubilizza in presenza di idrossido di sodio in atmosfera inerte dando fosfina e sodio ipofosfito:
P4 + 3 NaOH + 3 H2O → PH3 + 3 NaH2PO2
Si incendia spontaneamente alla temperatura di 50°C secondo la reazione:
P4 + 5 O2 → P4O10
Per questa ragione è utilizzato in alcuni tipi di munizioni.
Fosforo rosso
È più stabile e meno reattivo del fosforo bianco, non è tossico, non mostra chemiluminescenza. Può essere ottenuto riscaldando il fosforo bianco, in assenza di aria a 300°C. In tali condizioni si presenta amorfo ma per ulteriore riscaldamento si cristallizza in una struttura polimerica
È usato come ritardante della fiamma e nella produzione illecita di alcuni stupefacenti
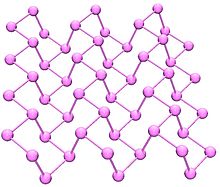
Fosforo nero
È la forma allotropica più stabile e può essere ottenuto dal fosforo bianco a pressioni elevatissime. Nell’aspetto, nelle proprietà e nella struttura è molto simile alla grafite essendo anch’esso di colore scuro, friabile, conduttore di elettricità. Ha una struttura ortorombica costituita da anelli a sei membri in cui ogni atomo è legato ad altri tre
La più importante somiglianza del fosforo nero con la grafite è la possibilità di poter essere ottenuto in monostrati dotati di eccellenti proprietà di trasporto di cariche ed elevata conduttività termica. Questo materiale detto fosforene è attualmente di grande interesse per la comunità scientifica.