Gli azeotropi o miscele azeotropiche sono miscele di due o più liquidi che non variano la propria composizione per semplice distillazione.
La maggior parte delle soluzioni non si comporta idealmente quindi la loro pressione di vapore non obbedisce alla legge di Raoult.
Ad esempio, una miscela la cui pressione di vapore sia maggiore di quella prevedibile sulla base della legge di Raoult, per esempio una miscela di benzene ed etanolo manifesta una deviazione positiva, mentre le miscele come cloroformio acetone presentano una deviazione negativa dalla legge di Raoult.
Entalpia di mescolamento
Il segno della deviazione può essere correlato all’entalpia di mescolamento ΔHmix, ovvero con la differenza di entalpia tra la miscela e l’insieme dei componenti separati.
Infatti l’entalpia di mescolamento di etanolo e benzene è positiva e così anche la deviazione dalla legge di Raoult (essendo il mescolamento endotermico), mentre l’entalpia di mescolamento di cloroformio e acetone è negativa e così anche la deviazione dalla legge di Raoult (essendo il mescolamento esotermico).
Il segno negativo dell’entalpia di mescolamento indica che le interazioni tra le molecole di acetone e cloroformio sono più favorevoli rispetto a quelle esistenti tra le molecole separate: mentre si forma la miscela viene liberata energia.
Strutture molecolari
Per capire la motivazione di tale fenomeno conviene visualizzare le strutture molecolari di entrambe le molecole: nel caso del sistema benzene etanolo l’entalpia di mescolamento positiva implica che le forze intermolecolari tra i due composti sono meno favorevoli di quelle tipiche dell’uno e dell’altro componente puro e pertanto la formazione della miscela assorbe energia.
Nel caso del benzene liquido puro le molecole sono unite da forze di London, mentre nell’etanolo vi sono forti legami a idrogeno.
Quando questi due liquidi vengono mescolati molti di questi legami sono costretti a scindersi.
Nel caso del sistema cloroformio (CHCl3 ) e acetone (CH3COCH3), invece, si deve considerare il fatto che il primo è una molecola polare avente un momento dipolare relativamente elevato in cui l’idrogeno possiede una parziale carica positiva, che, quando si avvicina a una molecola di acetone subisce l’attrazione nei confronti dei doppietti elettronici solitari dell’ossigeno.
Tali attrazioni sono forti e paragonabili a quelle che avvengono nel legame a idrogeno. Le deviazioni dalla legge di Raoult condizionano la distillazione delle miscele: i diagrammi in cui vengono riportati la composizione in funzione della temperatura relativi alle dette miscele ne rivelano la ragione.
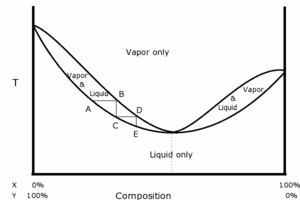
Il significato della deviazione positiva dalla legge di Raoult è che il punto di ebollizione della miscela è più basso di quanto preveda la legge di Raoult come si può vedere in figura:
per alcune coppie di componenti esso può essere più basso perfino del punto di ebollizione dell’uno e dell’altro componente puri.
Azeotropi bassobollenti
Le miscele la cui temperatura di ebollizione è inferiore a quella dei componenti puri si dicono azeotropi bassobollenti ovvero che presentano un minimo del punto di ebollizione. I loro componenti non si possono separare per distillazione, Infatti nel corso della distillazione stessa bolle per prima la miscela anziché il liquido puro più volatile.
Azeotropi altobollenti
Il comportamento opposto viene esibito dalla miscela tra acetone e cloroformio come si può vedere in figura:
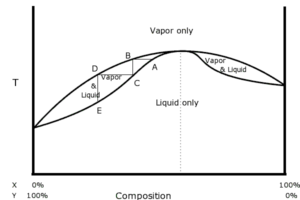 infatti questo è un azeotropo altobollente che presenta un massimo del punto di ebollizione e infatti bolle a una temperatura maggiore a quella dell’uno e dell’altro costituente cosicché costituirà l’ultima frazione raccolta che non coinciderà perciò con il liquido puro meno volatile.
infatti questo è un azeotropo altobollente che presenta un massimo del punto di ebollizione e infatti bolle a una temperatura maggiore a quella dell’uno e dell’altro costituente cosicché costituirà l’ultima frazione raccolta che non coinciderà perciò con il liquido puro meno volatile.
Lo studio del comportamento alla distillazione frazionata di miscele di liquidi che formano un azeotropo, può essere fatto dividendo idealmente il diagramma di stato relativo in due zone distinte tracciando una linea verticale immaginaria a partire dal punto delle ascisse corrispondente alla composizione dell’azeotropo.
Le due zone così ottenute vengono poi esaminate separatamente considerando l’azeotropo come un componente puro. Ad esempio, dal diagramma della distillazione frazionata di miscele etanolo benzene otteniamo due zone: quella a sinistra dell’azeotropo viene considerata come appartenente a un diagramma benzene-azeotropo, mentre la zona a destra dell’azeotropo viene considerata appartenente a un diagramma azeotropo- etanolo.
Pertanto tenendo conto che nel corso della distillazione frazionata la fase vapore si arricchisce del componente più volatile, partendo da una miscela etanolo- benzene la cui componente più volatile è a destra dell’azeotropo, si ottiene come distillato ( vapori condensati ) l’azeotropo e come residuo della distillazione il benzene puro.
In tabella vengono riportate le caratteristiche di alcuni azeotropi delle più comuni miscele binarie
|
Componente |
Punto di ebollizione |
Punto di ebollizione dell’azeotropo |
Composizione % in peso dell’azeotropo |
|
Alcol etilico Acqua |
78.5 100 |
78.2 |
96.3 3.7 |
|
Benzene Alcol etilico |
80 78.5 |
66 |
67.45 32.55 |
|
Alcol propilico Acqua |
97.2 100 |
87.7 |
71.7 28.3 |
|
Acido cloridrico Acqua |
-83.7 100 |
110 |
20.1 79.9 |
|
Alcol metilico Acetone |
64.7 56.5 |
56 |
86.5 13.5 |
|
Alcol etilico Tetracloruro di carbonio |
78.5 76.8 |
65 |
15.8 84.2 |