La spettrofotometria è una tecnica analitica, qualitativa e quantitativa che permette il riconoscimento e la determinazione di una sostanza in base al suo spettro di assorbimento.
La spettrofotometria è la misurazione quantitativa dell’interazione delle radiazioni ultraviolette (UV), visibili e infrarosse (IR) con un materiale e ha un impatto su un ampio campo della scienza e della tecnologia.
Il campo di lunghezze d’onda che interessa la spettrofotometria visibile e ultravioletta è compreso tra 190 nm e 2500 nm.
La regione tra 2500 e 600 nm è detta del vicino infrarosso e interessa direttamente l’analisi dei composti composti metallorganici e di coordinazione in quanto in tale intervallo cadono gli assorbimenti dovuti alle transizioni d-d e a quelle f-f dei lantanidi.
La regione compresa tra 750 nm (rosso) e 400 nm è detta del visibile comprende ancora le transizioni d-d e f-f sopra menzionate e inoltre quelle di trasferimento di carica che coinvolgono orbitali d o f dei metalli e degli orbitali dei leganti.
Quella compresa tra 400 e 190 nm è detta del vicino ultravioletto e interessa l’analisi dei composti organici isolati o presenti come leganti nei complessi.
Al di sotto di 190 nm si parla di lontano ultravioletto, ma tale regione dello spettro non ha applicazioni analitiche.
Le informazioni della spettrofotometria del vicino infrarosso e del visibile risultano valide e diagnostiche agli effetti di una determinazione di geometria del complesso e di numero di ossidazione quando vengono accoppiate con le informazioni di tecniche spettromagnetiche, quale ad esempio la risonanza di spin elettronico; altrimenti la loro validità analitica è limitata entro una serie di composti simili.
Spettrofotometria e molecole organiche
Assai più diagnostici risultano, invece, gli assorbimenti dovuti a molecole organiche, per le quali gli assorbimenti nell’ultravioletto risultano poco perturbati anche quando sono uniti con legame coordinativo a un metallo.
Per esempio nella zona del lontano ultravioletto cadono gli assorbimenti dovuti alla presenza di idrocarburi saturi e, più in generale, di tutte le sostanze prive di doppi legami.
Nella regione del vicino ultravioletto gli assorbimenti sono con buona possibilità assegnabili a gruppi insaturi, doppi o tripli legami, o ad atomi recanti coppie elettroniche non impegnate in legami. Nel visibile gli assorbimenti sono associabili a gruppi insaturi fortemente coniugati.
In generale un gruppo che dà luogo ad assorbimento nel vicino ultravioletto o nel visibile è detto cromoforo.
Dato che quasi tutte le sostanze organiche presentano un assorbimento nella regione visibile-ultravioletto si può comprendere l’importanza di tale spettrofotometria dal punto di vista sia dell’indagine strutturale sia da quello analitico. L’analisi elettronica si esegue solitamente in soluzione ed è, quindi, molto importante scegliere un solvente che non assorba nella regione che si intende analizzare o per lo meno che abbia debole assorbimento in tale zona.
Spettrofotometro
La spettrofotometria strumentale divenne disponibile in commercio intorno al 1940 con l’introduzione dello spettrofotometro. Lo schema essenziale di uno spettrofotometro, scoperto dal chimico statunitense Arnold Orville Beckman si può dividere in quattro parti:
- La sorgente o le sorgenti di energia raggiante
- La sezione di monocromatizzazione della radiazione
- Il sistema porta campioni
- La sezione di rivelazione del segnale
In funzione delle qualità ottiche e meccaniche delle varie parti sopra descritte si avranno, poi, strumenti più o meno sensibili che comunemente vengono classificati come spettrofotometri per analisi o di routine. Una caratteristica fondamentale dello spettrofotometro è il potere risolutore. Quest’ultimo indica il minimo intervallo tra due lunghezze d’onda assorbite indispensabile perché queste possano essere rivelate dallo strumento.
Gli strumenti possono essere suddivisi in due categorie:
- Spettrofotometri a singolo raggio
- Spettrofotometri a doppio raggio
Gli strumenti a singolo raggio sono sia otticamente che meccanicamente più semplici di quelli a doppio raggio e vengono impiegati nell’analisi di routine il cui schema è rappresentato in figura:
 Sorgente
Sorgente
La sorgente della radiazione visibile o ultravioletta è costituita da una lampada a filamento di tungsteno che fornisce lo spettro di frequenze del vicino infrarosso e del visibile, mentre una lampada a idrogeno fornisce lo spettro di frequenze dell’ultravioletto. Nella lampada a idrogeno la radiazione è originata da una scarica elettrica che si fa avvenire in una camera contenente idrogeno sotto pressione.
Dalla sorgente la radiazione è inviata alla fenditura con un sistema di specchi; la fenditura non deve essere troppo sottile per non creare fenomeni di diffrazione. Dalla fenditura la radiazione giunge al monocromatore che può essere un prisma o un reticolo. Uscita dal monocromatore la radiazione passa nuovamente attraverso la fenditura che ha ora lo scopo di lasciar passare solo la frequenza richiesta e di riflettere tutto il resto dello spettro. La radiazione monocromatica così ottenuta attraversa il campione in esame e, all’uscita dallo stesso, è analizzata dal rivelatore che può essere un fototubo o una fotocellula.
Registrazione dello spettro
Per registrare uno spettro si pone la sostanza da analizzare sciolta nel solvente opportuno nella cella di quarzo; in un’altra cella identica si pone il solo solvente. Intercettando il raggio si azzera lo strumento sullo zero di trasmittanza; ponendo la cella con il solo solvente sul cammino del raggio si impone una trasmittanza del 100% eliminando così l’effetto dovuto all’assorbimento del solvente. Si sostituisce alla cella contenente il solo solvente quella contenente il campione da esaminare e si osserva la trasmittanza segnata dall’ago dello strumento. Riportando in un grafico in ascissa le lunghezze d’onda e in ordinata le percentuali di trasmissione, si costruisce per punti lo spettro ultravioletto della sostanza.
Più complessi si presentano gli strumenti a doppio raggio.
Dalla sorgente la radiazione passa attraverso la fenditura ed è inviata al monocromatore mediante lo specchio. La radiazione monocromatica viene selezionata tramite la fenditura e inviata al partitore di raggi. Dal partitore la radiazione viene inviata alternativamente al campione o al riferimento. Alternativamente, poi, i raggi uscenti rispettivamente dal campione o dal riferimento sono trasmessi al rivelatore.
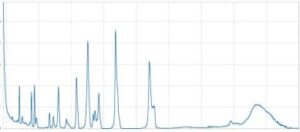
Le operazioni necessarie per la registrazione di uno spettro con uno spettrofotometro a doppio raggio sono simili a quelle per lo strumento a raggio singolo. La registrazione dello spettro è in questo caso automatica ed è, quindi, necessario fissare a priori il tempo di scansione delle frequenze, cioè la velocità con cui si vuole ottenere lo spettro che deve essere compatibile con la sensibilità dello strumento e adeguata all’impiego che si desidera fare con lo spettro ottenuto.
Gli spettri elettronici delle molecole organiche rivelano essenzialmente gli assorbimenti dovuti a elettroni impegnati in legami multipli e a doppietti elettronici non impegnati in legami. Mentre per le molecole semplici la relazione tra posizione dell’assorbimento e assegnazione alla corrispondente transizione elettronica è evidente, nelle molecole complesse tale relazione è spesso empirica ed è necessario conoscere a fondo l’assorbimento dei cromofori più comuni per poter sfruttare lo spettro in problemi di determinazione di struttura.
Tabella
In tabella sono riportati alcuni cromofori organici con l’assegnazione della transizione responsabile dell’assorbimento.
|
Gruppo cromoforico |
Esempio |
Λmax(nm) |
ε(Lmol-1cm-1) |
Solvente |
Origine
|
|
Etilenico |
Etilene |
171 |
10000 |
Vapore |
π→π* |
|
Acetilenico |
Acetilene |
173 |
6000 |
Vapore |
π→π* |
|
Aromatico |
Benzene |
256 |
200 |
Cicloesano |
π→π* |
|
Carbonile |
Acetone |
188 |
1860 |
Isottano |
π→π* |
|
277 |
17 |
Isottano |
n→π* |
||
|
Carbossile |
Acido acetico |
180 |
Intensa |
Vapore |
π→π* |
|
204 |
60 |
Acqua |
n→π* |
La posizione dei massimi e l’intensità dipendono anche dai gruppi presenti nella molecola.
Effetto batocromo (red shift) e effetto ipsocromo
Si parla di effetto batocromo (red shift) o effetto ipsocromo causati da questi gruppi se gli spostamenti dei massimi sono rispettivamente verso maggiori o minori lunghezze d’onda e di effetto ipercromico o ipocromico se si ha rispettivamente aumento o diminuzione di intensità. Esistono poi dei gruppi detti auxocromi che, pur non avendo assorbimenti intensi, provocano notevoli effetti ipercromici quando sono adiacenti o coniugati ad altri cromofori. Nella tabella vengono riportati esempi di alcuni gruppi auxocromi:
|
Gruppo |
Esempio |
Λmax(nm) |
ε(Lmol-1cm-1) |
Stato |
Origine |
|
-I |
Ioduro di metile |
259 |
3640 |
Vapore |
|
|
-Br |
Bromuro di metile |
204 |
200 |
Vapore |
|
|
-Cl |
Cloruro di metile |
173 |
200 |
Vapore |
|
|
-OH |
Metanolo |
184 |
151 |
Vapore |
|
|
-S- |
Dimetilsolfuro |
210 |
1000 |
Vapore |
|
|
-N< |
215 |
600 |
Vapore |
E’ interessante osservare la serie CH3I, CH3Br, CH3Cl in cui è evidente l’effetto dell’elettronegatività degli alogeni sulla Λmax di assorbimento: l’aumento di elettronegatività passando dallo iodio al cloro fa sì che gli elettroni di non legame si leghino più strettamente all’alogeno, con il risultato di spostare la Λmax verso lunghezze d’onda minori.
