Le reazioni di aldeidi e chetoni più caratteristiche sono le addizioni al doppio legame carbonio-ossigeno presente nel gruppo carbonilico.
Nella loro forma più semplice le reazioni di aldeidi e chetoni coinvolgono l’attacco di una specie nucleofila al carbonio carbonilico. Si ottiene un intermedio tetraedrico in cui l’ossigeno porta la carica negativa come si può vedere in figura:

alternativamente, nelle reazioni di addizione acido-catalizzate, si ha prima una associazione dell’elettrofilo all’ossigeno carbonilico, attivando così il carbonio carbonilico al successivo attacco nucleofilo. Per illustrare i fattori che governano le reazioni di addizione al carbonile, consideriamo l’addizione di acqua ad aldeidi e chetoni come si può vedere in figura:

Reazioni di aldeidi e posizione dell’equilibrio
La posizione dell’equilibrio in queste reazioni può essere influenzata sia dall’ingombro che dagli effetti elettronici dei gruppi sostituenti.
Da notare che nella forma idrata i gruppi sostituenti si trovano fra loro più vicini (angoli di 109.5°) che non nel composto di partenza (angoli di 120°). Ci si può aspettare che con sostituenti R molto ingombranti si possa non avere idratazione.
I fattori elettronici possono operare pro o contro la formazione dei prodotti di addizione.
I fattori che stabilizzano il composto carbonilico rispetto al prodotto di addizione sposteranno l’equilibrio verso la forma carbonilica e viceversa.
La formaldeide H2C=O è quasi completamente idratata, mentre l’acetone (CH3)2C=O è idratato in maniera trascurabile all’equilibrio.
Ciò è dovuto all’effetto stabilizzante dei gruppi metilici elettrondonatori sul doppio legame carbonilico.
I gruppi alchilici, quindi, sia per effetti elettronici che per effetti sterici, aumentano la stabilità della forma carbonilica rispetto al prodotto di addizione.
Nei composti come la tricloroacetaldeide rappresentata in figura la forma carbonilica è destabilizzata dai gruppi alogeni fortemente elettronegativi. Per questo l’idrato di cloralio 2,2,2-tricloro, 1,1 etandiolo sono tra i pochi esempi di dioli geminali isolati.
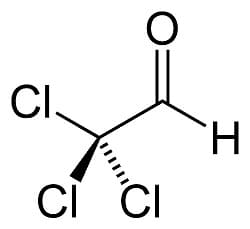
L’idrato di cloralio è un potente sonnifero ad azione veloce, noto negli U.S.A. come gocce knockout. Inoltre il Mickey Finn, bevanda somministrata all’insaputa di un malcapitato, è un mix di alcool e idrato di cloralio che ha l’effetto di far perdere conoscenza.
Gli effetti sterici ed elettronici non influenzano solamente la posizione dell’equilibrio, nella semplice reazione reversibile di addizione al carbonile. Influenzano fortemente anche la velocità della reazione di addizione.
Prodotti di addizione
I fattori che stabilizzano o destabilizzano i prodotti di addizione rispetto a quelli di partenza hanno un effetto analogo sull’energia relativa dello stato di transizione che porta ai prodotti stessi.
Ad esempio nelle semplici reazioni di addizione la formaldeide H2C=O, il ciclopropanone C3H4O e l’esafluoroacetone F3CCOCF3 sono più reattivi ( reagiscono più velocemente) dell’acetone CH3COCH3.
La velocità di addizione di una qualunque molecola AB a un composto carbonilico può variare:
- con la struttura del composto carbonilico
- con le condizioni in cui si conduce l’addizione.
Nel caso dell’idratazione dell’acetaldeide CH3COH la reazione è molto lenta a pH 7 ma procede più rapidamente via via che il pH diminuisce per la protonazione dell’ossigeno carbonilico o via via che aumenta per l’attacco nucleofilo dello ione OH– al carbonio carbonilico.
Addizione di alcoli
Le reazioni di aldeidi e i chetoni con alcoli dando luogo rispettivamente alla formazione di emiacetali e di emichetali come si può vedere in figura:

la formazione di semplici emiacetali ed emichetali può essere facilitata con catalisi sia acida che basica, ma in genere sia gli emiacetali che gli emichetali sono troppo instabili per permetterne l’isolamento.
In presenza di acidi minerali gli emiacetali e gli emichetali reagiscono con un’altra molecola di alcol per formare l’acetale o il chetale secondo il seguente schema:

I chetali e gli acetali sono molto stabili alle basi e poco stabili agli acidi.
Questa combinazione di instabilità agli acidi e di stabilità alle basi li rende dei reagenti utili come gruppi protettori che possono proteggere i gruppi aldeidici o carbonilici presenti nella molecola in modo da non farli reagire, mentre nella molecola stessa si fanno avvenire delle trasformazioni chimiche su altri gruppi presenti.
