I gruppi attivanti nelle reazioni di sostituzione elettrofila aromatica attivano l’anello benzenico ad una ulteriore sostituzione.
Agli inizi dello scorso secolo si evidenziò che la presenza di alcuni gruppi determinavano anche l’orientazione delle reazioni.
L’osservazione di rilievo, che necessitava di una spiegazione, era che un sostituente A, già presente sull’anello benzenico, orientava la posizione di un secondo gruppo B. Delle tre possibili posizioni isomere, orto, meta e para, disponibili per il gruppo sostituente B, i dati sperimentali evidenziarono che alcuni sostituenti iniziali A orientavano la sostituzione di B principalmente nelle posizioni orto e para, mentre altri principalmente nella posizione meta.
Le posizioni orto, meta e para sono visibili in figura:
I primi chimici trovarono che le orientazioni relative dei sostituenti nei prodotti di reazione non dipendevano dal tipo di elettrofilo usato, bensì dal tipo di sostituente presente nel derivato benzenico su cui avveniva la sostituzione elettrofila.
Nitrobenzene
Ad esempio il nitrobenzene porta esclusivamente a dei prodotti finali che sono meta-n si ottiene, come si è detto il meta-bromonitrobenzene.
Sarà bene ricordare che esistono due meccanismi tramite i quali un gruppo può attrarre o donare elettroni rispetto al substrato a cui è legato (in questo caso l’anello benzenico) : l’effetto induttivo e l’effetto di risonanza.
Per il nitrobenzene i due ossigeni legati all’azoto esercitano un effetto elettronattrattore a causa della loro grande elettronegatività in modo che l’azoto funziona a sua volta come elettronattrattore nei confronti dell’anello benzenico a cui è legato. Quindi l’effetto induttivo del nitro gruppo deattiva l’anello. Esiste inoltre un effetto di risonanza come si vede in figura:
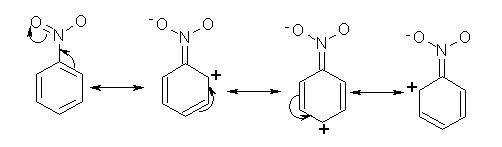
E’ da rilevare come alcune di queste forme localizzano una carica positiva nel benzene mentre in nessun caso si ha la localizzazione di cariche negative.
Tale fenomeno deattiva l’anello a successivi attacchi di elettrofili. Si può notare che la carica positiva introdotta dal nitro gruppo nell’anello si trova nelle posizioni orto e para e quindi la densità di carica elettronica in meta è più alta che nelle altre posizioni.
Le considerazioni sulla risonanza suggeriscono quindi che l’elettrofilo attacchi in posizione meta, che è ciò che si verifica. L’effetto induttivo riduce a sua volta la densità elettronica in tutte le posizioni dell’anello rendendo ancora più improbabile la reazione. Quindi l’attacco elettrofilo ad una molecola di nitrobenzene è difficile e la reazione procede lentamente ma se deve avvenire va alla posizione meta, cioè a quella che risulta la posizione meno disattivata.
Anilina
Consideriamo ora l’anilina (fenilammina): l’elettronegatività di un orbitale del carbonio sp2 è intermedia tra quella di un orbitale sp3 dell’azoto (che è più elettronegativo) e un orbitale p dell’azoto che è meno elettronegativo.
Poiché gli orbitali di legame nell’azoto amminico hanno un carattere intermedio tra p e sp3, l’azoto in una molecola del tipo dell’anilina è simile all’atomo di carbonio per quel che riguarda l’elettronegatività per cui l’effetto induttivo del gruppo amminico legato al benzene è piccolo.
Risonanza
E’ però presente un forte effetto di risonanza. Il doppietto solitario è parzialmente delocalizzato dentro l’anello aromatico e pertanto l’anilina ha un forte eccesso di elettroni disponibili nell’anello aromatico per risonanza e quindi è molto reattiva rispetto agli elettrofili. Poiché la carica negativa è presente nelle forme limite di risonanza nelle posizioni orto-para, l’anilina si comporta da attivante orto,para-direttore.
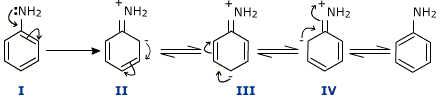
In generale quindi i gruppi deattivanti sono meta-direttori mentre quelli attivanti sono orto,para-direttori. Un caso a parte è costituito dal clorobenzene: il cloro infatti è altamente elettronegativo e chiaramente l’effetto induttivo del cloro rimuove gli elettroni dall’anello deattivandolo in modo sensibile. Tuttavia l’atomo di cloro è anche analogo almeno parzialmente, grazie ai suoi doppietti elettronici solitari, all’azoto dell’anilina, come si può vedere in figura

e pertanto, a causa di questi due effetti opposti il clorobenzene è un orto-para-direttore anche se il cloro si comporta nel suo insieme come un deattivante.
Nella seguente tabella vengono riportate le classificazioni dei comuni gruppi sostituenti per quel che riguarda gli effetti di orientazione sulle sostituzioni elettrofile aromatiche.
Tabella
| Orto, para-direttori | Meta-direttori |
| Forti: – NH2, – NHR, – NR2, OH– | – NO2. – NH3+, – NR3+ |
| Medi: -OR, -CH3 -, -NHCOCH3 | -C N, – SO3H |
| Deboli: -R, -Ph, -F, -Cl, -Br, -I | -CHO, -COR, -COOR, – COOH |
Al fine di poter progettare un reazione di sintesi sarà utile considerare la classificazione dei gruppi sostituenti comuni, secondo i loro effetti attivanti sulle sostituzioni elettrofile aromatiche
| Gruppi attivanti | Gruppi deattivanti |
| Forti: -NH2, -NHR, -NR2, -OH | -NO2, -NR3+ |
| Medi : -OR, -NHCOR, -CH3 | -C≡N, – CHO, -COR, -COOH |
| Deboli: -Ph, – alchili | -F, -Cl, – Br, -I |
Esempio
Un’applicazione di quanto detto è costituita dal seguente problema:
Si preveda la via sintetica a partire dal benzene per ottenere il paranitrotoluene.
Discussione: effettuando la nitrazione del benzene si ottiene il nitrobenzene che è un deattivante meta direttore quindi il prodotto della reazione è il metanitrotoluene. La via da seguire è invece la seguente: a partire dal benzene, tramite un’alchilazione di Friedel-Crafts, si ottiene il toluene che è un attivante orto,para-direttore. La nitrazione del toluene poterà al prodotto desiderato.
Al contrario la via sintetica per ottenere il metanitrotoluene consiste nella nitrazione del benzene seguita dal una alchilazione

