La teoria del colore prende spunto dai colori di base della percezione visiva ovvero il giallo, il rosso e il blu, dai quali, per mescolanza, discendono tutti gli altri colori
Secondo la teoria del colore le sostanze colorate sono quelle sostanze capaci di assorbire le radiazioni dello spettro elettromagnetico percepibili dall’occhio umano e che costituiscono la luce visibile.
Le radiazioni elettromagnetiche sono rappresentate da onde sinusoidali aventi lunghezza d’onda λ, frequenza ν ed energia E. La velocità della radiazione è data da c = λν = 3 ∙ 1010 cm/s.
L’energia della radiazione, direttamente proporzionale alla frequenza e inversamente proporzionale alla lunghezza d’onda è data dalla relazione E = hν = hc/λ .
Nell’espressione h è la costante di Planck uguale a 6.624 ∙ 10-27 erg s.
La lunghezza d’onda è generalmente espressa in micrometri (1 μm =10-4 cm) o in nanometri ( 1 nm = 10-7 cm) mentre la frequenza è espressa in s-1.
Quando una molecola è sottoposta a radiazioni che coprono un largo intervallo di lunghezze d’onda sono assorbite solo quelle radiazioni la cui energia corrisponde alla differenza ΔE fra due livelli energetici della molecola.
Mentre l’assorbimento delle microonde (λ > 25 μm) e delle radiazioni infrarosse ( 0.8-25 μm) provoca solo cambiamenti nell’energia rotazionale e vibrazionale delle molecole, l’assorbimento delle radiazioni visibili ( 400-800 nm) e ultraviolette ( 100-400 nm) a causa della loro energia, porta gli elettroni agli stati eccitati.
Non c’è quindi nessuna differenza di principio fra spettri ultravioletti e spettri visibili. Il fatto di vedere incolore una sostanza che assorbe nella regione dell’ultravioletto dipende solo dall’incapacità del nostro occhio a percepire tali radiazioni.
Le sostanze colorate, infatti, assorbono nella ristretta regione del visibile in cui sono compresi i colori dell’arcobaleno che, nel loro insieme formano la luce bianca.
Nella tabella sono riportati i colori delle sostanze che assorbono le radiazioni di una data lunghezza d’onda secondo la teoria del colore
Tabella
|
λ (nm) |
Luce assorbita |
Colore osservato |
|
400-435 |
Violetto |
Giallo-verde |
|
435-480 |
Blu |
Giallo |
|
480-490 |
Verde-blu |
Arancione |
|
490-500 |
Blu-verde |
Rosso |
|
500-560 |
Verde |
Rosso-violetto |
|
560-580 |
Giallo-verde |
Violetto |
|
580-595 |
Giallo |
Blu |
|
595-605 |
Arancione |
Verde-blu |
|
605-750 |
Rosso |
Blu-verde |
Già nel secolo scorso furono fatti molti studi per capire la relazione esistente tra costituzione chimica e colore. Nel 1868 Graebe e Liebermann notarono che molte sostanze colorate erano decolorate per riduzione e quindi essi associarono il colore all’insaturazione delle molecole.
Nel 1876 Witt giunse alla conclusione che tutte le sostanze colorate dovevano contenere un gruppo cromoforo, cioè un gruppo responsabile del colore.
Cromofori e teoria del colore

Per Witt tali gruppi erano: -NO2, -NO, -N=N-, C=O e C=C. Oggi sono considerati cromofori anche altri gruppi che mostrano siti di insaturazione. Le molecole contenenti i cromofori furono chiamate cromogeni. Alcuni cromogeni sono di per sé colorati: il nitrosobenzene è verde, il fulvene ( 5-metilen-1,3- ciclopentadiene) è giallo. Molti cromogeni sono incolori, altri poco colorati e diventano più colorati per l’introduzione di alcuni aggruppamenti che Witt chiamò auxocromi.
Questi gruppi hanno deboli proprietà acide o basiche del tipo: -NH2, -NHR, -NR2 e –OH. Secondo Witt l’auxocromo non solo sviluppa il colore, ma introduce nella molecola capacità tintoriali. Furono elaborate ulteriori teorie, ma solo con lo sviluppo della meccanica ondulatoria di Schrödinger fu possibile uno studio del colore in termini di livelli energetici.
Per capire il colore, infatti, è necessario conoscere i livelli energetici dello stato fondamentale e dello stato eccitato delle molecole.
Funzione d’onda
La funzione d’onda ψ e l’energia E associate a un certo stato elettronico, sia esso lo stato fondamentale o uno stato eccitato, possono essere ottenute dalla soluzione dell’opportuna equazione di Schrödinger:
H ψ = E ψ
dove H è l’operatore hamiltoniano per il sistema molecolare in esame. Per sistemi polielettronici, tuttavia, bisogna ricorrere a metodi di risoluzione approssimati quali il metodo dell’orbitale molecolare e il metodo del legame di valenza. In particolare il metodo dell’orbitale molecolare (MO) tiene conto della formazione di orbitali molecolari come combinazione di orbitali atomici interagenti (LCAO).
Per una molecola biatomica AB in cui si abbia interazione tra i due orbitali atomici ψA e ψB la combinazione può avvenire con formazione di un orbitale a più bassa energia Φ1 (orbitale legante) o per produrre un orbitale a più alta energia Φ2 ( orbitale antilegante):
Φ1 = N1(ψA + C1 ψB)
Φ1 = N1(ψA – C1 ψB)
In cui N1 e N2 indicano fattori di normalizzazione e C1 e C2 fattori di mescolamento. In accordo con il principio di esclusione di Pauli e con la regola di Hund i due elettroni di legame della molecola AB avranno spin opposti e andranno a occupare l’orbitale legante a minor energia.
La molecola AB può assorbire energia luminosa quando uno dei due elettroni di legame è portato dall’orbitale di legame all’orbitale di orbitale di antilegame, processo che corrisponde a una transizione dallo stato fondamentale allo stato eccitato.
La differenza tra Φ1 e Φ2 determina quindi la lunghezza d’onda dell’assorbimento. Se la molecola AB contiene solo elettroni σ la transizione si indica σ →σ*. Per molecole contenenti elettroni π e n (elettroni non leganti in coppie solitarie) si possono avere transizioni π→ π* , n → σ*, n → π*.
Energia degli orbitali molecolari
L’ordine di energia degli orbitali molecolari è il seguente σ < π < n < π* < σ*.
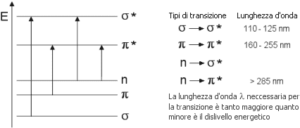 Le transizioni σ →σ* sono quelle a maggior energia e risultano prevalentemente nell’ultravioletto. Le transizioni n → π* richiedono generalmente energia minore di quelle π→ π* e quindi determinano un assorbimento a lunghezze d’onda maggiori.
Le transizioni σ →σ* sono quelle a maggior energia e risultano prevalentemente nell’ultravioletto. Le transizioni n → π* richiedono generalmente energia minore di quelle π→ π* e quindi determinano un assorbimento a lunghezze d’onda maggiori.
Entrambe possono avere energia corrispondente al visibile e quindi sono quelle che interessano i coloranti. Le bande cui queste transizioni danno origine possono essere spostate a lunghezze d’onda maggiori per effetto di coniugazione. Lo spostamento delle bande di assorbimento a lunghezze d’onda maggiori viene chiamato spostamento batocromo.
Il caso contrario di spostamento a lunghezze d’onda minori viene chiamato ipsocromo. Nell’etilene la transizione π→ π* determina un assorbimento a 180 nm e pertanto l’etilene risulta incolore. Nel butadiene in cui sono presenti due doppi legami coniugati si ha uno spostamento batocromo delle bande alla lunghezza d’onda di 217 nm, ma non raggiunge il campo del visibile pertanto anche il butadiene risulta incolore.
L’aumento di coniugazione provoca lo spostamento nella regione del visibile avviene quando nella molecola sono presenti più doppi legami. Si possono trarre quindi le seguenti conclusioni:
1) Il colore di un composto è strettamente legato alla presenza di specifici raggruppamenti, dotati di legami in grado di consentire un’elevata mobilità agli elettroni (per esempio sotto forma di possibile risonanza tra più strutture molecolari)
2) Il colore di un composto è funzione del numero e del tipo di gruppi cromofori complessivamente presenti in una molecola.
