Il modello degli orbitali ibridi parte dagli orbitali atomici per giustificare la formazione del legame tra gli atomi
Se, per esempio, si vuole giustificare il legame chimico nel metano si deve avanzare l’ipotesi che il carbonio usi i tre orbitali p e l’orbitale s per legarsi ai quattro atomi di idrogeno.
Se tali orbitali fossero utilizzati così come sono disposti nell’atomo isolato non si potrebbe spiegare la geometria tetraedrica osservata per questa molecola: infatti i tre orbitali p formano tra loro angoli di 90° molto diversi quindi dall’angolo del tetraedro equilatero.
Inoltre l’orbitale s, avendo simmetria sferica, è ugualmente distribuito nella regione dello spazio intorno al nucleo. Queste considerazioni confermano che gli orbitali atomici devono essere modificati all’atto di formazione del legame.
Modello degli orbitali ibridi
Il modello degli orbitali ibridi si basa appunto sull’ipotesi che all’atto della formazione del legame gli orbitali di un atomo subiscano una modificazione: nel caso dell’atomo di carbonio ciò comporta che da tre orbitali p e da un orbitale s si formino quattro nuovi orbitali equivalenti detti ibridi che hanno caratteristiche intermedie tra quelle degli orbitali p e quelle degli orbitali s, con i loro assi di simmetria diretti verso i vertici di un tetraedro come mostrato in figura:
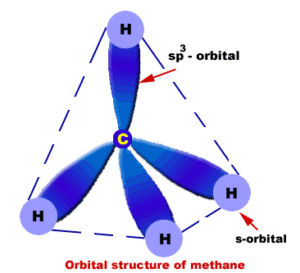 Se si considerano questo tipo di orbitali invece che di quelli atomici si può prevedere correttamente che i quattro legami carbonio-idrogeno siano equivalenti. Pertanto la molecola CH4 è tetraedrica. Gli orbitali sono detti orbitali ibridi sp3 in cui i quattro elettroni del carbonio occupano singolarmente ciascuno dei quattro orbitali ibridi aventi la stessa energia attraverso i quali il carbonio forma quattro legami con quattro atomi di idrogeno. Oltre all’ibridazione sp3 vi è anche l’ibridazione sp2 e sp.
Se si considerano questo tipo di orbitali invece che di quelli atomici si può prevedere correttamente che i quattro legami carbonio-idrogeno siano equivalenti. Pertanto la molecola CH4 è tetraedrica. Gli orbitali sono detti orbitali ibridi sp3 in cui i quattro elettroni del carbonio occupano singolarmente ciascuno dei quattro orbitali ibridi aventi la stessa energia attraverso i quali il carbonio forma quattro legami con quattro atomi di idrogeno. Oltre all’ibridazione sp3 vi è anche l’ibridazione sp2 e sp.
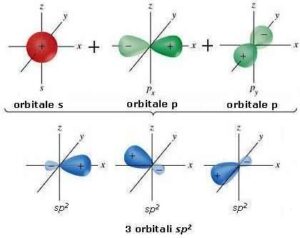
Nell’ibridazione sp2 i tre orbitali giacciono sullo stesso piano formando angoli di 120° tra di loro come si può vedere in figura:
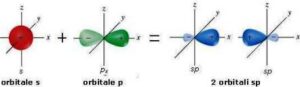
 mentre nell’ibridazione sp essi giacciono sulla stessa retta facendo un angolo di 180° tra loro come si può vedere in figura:
mentre nell’ibridazione sp essi giacciono sulla stessa retta facendo un angolo di 180° tra loro come si può vedere in figura:
 Un atomo ibridato sp2 avrà, quindi, una geometria triangolare intorno a sé mentre un atomo ibridato sp avrà geometria lineare.
Un atomo ibridato sp2 avrà, quindi, una geometria triangolare intorno a sé mentre un atomo ibridato sp avrà geometria lineare.
Il tipo di ibridazione per un particolare atomo è valutato contando il numero di coppie di legame σ che si dipartono dall’atomo e poi sommando a questo il numero di coppie non condivise. Se questo numero è quattro l’ibridazione è sp3, se è tre l’ibridazione è sp2, se è due l’ibridazione è sp.
Esempi
Ad esempio nella molecola di acqua intorno all’atomo di ossigeno sono presenti quattro coppie due di legame e due non condivise. L’atomo di ossigeno deve quindi usare un’ibridazione sp3 che comporta una geometria tetraedrica in accordo con l’angolo sperimentale H-O-H.
Lo ione nitrato, le cui strutture di risonanza sono rappresentate in figura:
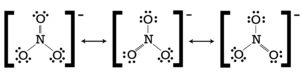 presenta tre coppie di legame σ intorno all’atomo di azoto. Non c’è nessuna coppia non condivisa quindi l’atomo di azoto usa orbitali ibridi di tipo sp2 che danno allo ione una geometria trigonale planare.
presenta tre coppie di legame σ intorno all’atomo di azoto. Non c’è nessuna coppia non condivisa quindi l’atomo di azoto usa orbitali ibridi di tipo sp2 che danno allo ione una geometria trigonale planare.
In aggiunta ai tipi di ibridazione sp3, sp2 ed sp vi sono altri due tipi di ibridazione: sp3d e sp3d2.
Consideriamo ad esempio il pentacloruro di fosforo PCl5.
La configurazione elettronica del fosforo è [Ne], 3s2, 3px1, 3py1, 3pz1. Affinché possa formarsi la molecola PCl5 è necessario che il fosforo abbia 5 elettroni spaiati: esso infatti promuove un elettrone dal livello 3s al livello 3d così la sua configurazione diviene [Ne], 3s1, 3px1, 3py1, 3pz1, 3d1 quindi il fosforo presenta 5 orbitali semipieni di cui un orbitale s, tre orbitali p e un orbitale d e forma cinque orbitali ibridi sp3d1 e forma cinque legami σsp3d-p con gli atomi di cloro ciascuno dei quali ha un elettrone spaiato nell’orbitale p. La geometria molecolare è trigonale bipiramidale.
Un esempio di ibridazione sp3d2 è costituito dall’esafluoruro di zolfo. La configurazione elettronica dello zolfo è [Ne], 3s2, 3px2, 3py1, 3pz1. Lo zolfo promuove un elettrone dal livello 3s e un elettrone dal livello 3px al livello 3d così la sua configurazione diviene [Ne], 3s1, 3px1, 3py1, 3pz1, 3d2 quindi ha sei orbitali semipieni di cui un orbitale s, tre orbitali p e due orbitali d e forma sei orbitali ibridi sp3d2 che formano sei legami σsp3d2-p con gli atomi di fluoro ciascuno dei quali ha un elettrone spaiato nell’orbitale p. La geometria della molecola è ottaedrica.
