Per la produzione del ferro dai minerali si ricorre a processi siderurgici nei quali i minerali sono ridotti con carbone, in generale coke metallurgico duro e poroso ottenuto per distillazione secca di litantraci.
Il ferro è il più abbondante dei metalli dopo l’alluminio e si ritiene che, assieme al nichel sia uno dei costituenti del nucleo terrestre.
E’ noto sin dall’antichità ed è diffusissimo in natura essendo presente in alcuni minerali come:
ematite Fe2O3
magnetite Fe3O4
limonite FeO(OH)
siderite FeCO3
pirite FeS2.
Quest’ultima è anche nota come oro degli stolti a causa della sua somiglianza con il ben più prezioso metallo. Stolti apparvero, infatti molti cercatori d’oro alle prime armi che erano tratti in inganno da questo minerale ritenendo che contenesse oro.
Produzione del ferro
Per la produzione del ferro i minerali di ferro preventivamente arrostiti per liberarli dall’acqua, del biossido di carbonio che si forma dalla decomposizione della siderite o della ganga calcarea e di parte dello zolfo, elemento particolarmente nocivo perché rende fragile l’acciaio. Alla massa di coke e minerale è aggiunta una quantità calcolata di fondente per scorificare la ganga che accompagna il minerale sotto forma di silicato di calcio Ca2SiO4.
Se la ganga è acida, cioè a base di silice e allumina, si aggiunge fondente basico, ossidi di calcio e di magnesio, mentre se la ganga è acida si aggiunge silice.
Il processo di riduzione si effettua a ciclo continuo in forni di refrattario alti fino a trenta metri e perciò detti altiforni, in cui si immette dall’alto la miscela bilanciata di minerale, coke e fondente e si spilla più volte al giorno dal crogiolo sottostante al forno il metallo fuso.
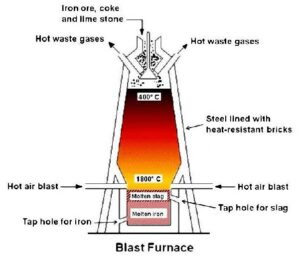
Al di sopra del liquido galleggia la scoria silicatica fusa che viene allontanata e utilizzata per farne cementi. Alla base del forno viene iniettata una corrente di aria preriscaldata (700-800 °C) e arricchita di ossigeno. L’ossigeno ossida il carbone con una reazione esotermica:
2 C + O2 → 2 CO ΔH = – 53.7 kcal
Questa reazione da una parte produce un riducente gassoso, il monossido di carbonio che si combina più facilmente con il minerale solido e dall’altra innalza la temperatura fino a far fondere il minerale prodotto nei processi di riduzione. Nell’altoforno si stabilisce un gradiente di temperatura che va da circa 200 °C alla sommità fino a circa 2000 °C nella zona bassa dove brucia il coke. Le reazioni cominciano nella zona alta al di sopra dei 400 °C dove l’ossido di carbonio riduce gli ossidi di ferro con reazioni successive che così possono essere schematizzate:
3 Fe2O3 + CO → 2 Fe3O4 + CO2
Fe3O4 + CO → 3 FeO + CO2
FeO + CO → Fe + CO2
Queste reazioni sono esotermiche e contribuiscono ad innalzare la temperatura. Il biossido di carbonio prodotto reagisce parzialmente con il carbone ridando il riducente gassoso:
C + CO2 → 2 CO
Lentamente il materiale scende verso il basso e nelle zone più calde del forno si verifica anche la riduzione diretta dell’ossido di ferro con carbone:
2 FeO + C → 2 Fe + CO2
Al di sopra dei 1000 °C il ferro comincia ad assorbire carbonio formando il carburo cementite Fe3C; comincia inoltre a formarsi una fase liquida che scorrendo sul coke si arricchisce ulteriormente in carbonio. Si tenga presente che la soluzione ferro-carbonio ha un punto eutettico, cioè un minimo di temperatura di fusione a 1145 °C. La massa fusa si raccoglie nel crogiolo e la scoria che galleggia su di essa protegge il ferro dall’ossidazione da parte dell’aria insufflata.
Ghisa
Il metallo prodotto nell’altoforno non è puro, esso costituisce la ghisa e contiene in media 4% di carbonio, 2.5% di silicio, 2% di fosforo, 0.1% di zolfo e fino a 2.5% di manganese.
La ghisa si può ottenere in due forme dette bianca e grigia rispettivamente:
- ghisa bianca si ottiene per raffreddamento rapido del prodotto dell’altoforno, contiene carbonio disciolto nel ferro ed è dura e fragile
- ghisa grigia si ottiene per raffreddamento lento in quanto al diminuire della temperatura e della solubilità del carbonio nel ferro, il carbonio si separa dallo stato grafitico.
Quella grigia che ha migliori proprietà meccaniche è usata per fare una grande quantità di oggetti che non debbano essere sottoposti a sollecitazione.
La gran parte della ghisa prodotta è convertita in acciaio attraverso processi di raffinazione consistenti:
-
- nell’ossidazione di quasi tutto il carbonio
- nella eliminazione del fosforo e dello zolfo
- nell’ aggiunta di altri metalli per conferire all’acciaio particolari caratteristiche.
Nel processo detto a crogiolo aperto la ghisa è mantenuta fusa in recipienti poco profondi e l’ossidazione viene effettuata con aria e aggiunta di ossidi di ferro sotto forma di minerali o rottami arrugginiti. Per facilitare la scorificazione dei componenti acidi si aggiunge ossido di calcio. Questo processo ha il vantaggio di produrre un acciaio di buona qualità, ma è piuttosto lento impiegando circa otto ore per ciclo di lavoro.
Processo Bessemer
Molto più rapido, circa 10-20 minuti per ciclo, ma con un prodotto di qualità inferiore, è il processo Bessmer, dal nome dell’ingegnere Henry Bessemer, in cui la ghisa proveniente direttamente dall’altoforno viene introdotta in un grosso recipiente a forma di pera detto convertitore Bessemer in cui viene insufflata aria che effettua l’ossidazione del carbonio, del silicio e del fosforo. Si aggiunge anche manganese che, ossidandosi, scorifica la silice sotto forma di silicato di manganese fusibile. Le reazioni di ossidazione sono esotermiche e perciò il ferro si mantiene fuso.
Con questo metodo di produzione del ferro si procede alla eliminazione quasi completa del carbonio che poi è reintrodotto in quantità controllata.
Per eliminare il fosforo, il cui ossido non è abbastanza volatile, si riveste il convertitore con mattoni refrattari basici che scorificano il fosforo come fosfato (scorie Thomas).
Altri processi per la produzione del ferro usano forni a riverbero (forni Martin) e forni elettrici: questi ultimi sono usati per produrre acciai speciali. L’acciaio contiene tra 0.2 e 1.5% di carbonio. Gli acciai a basso contenuto di carbonio (acciai dolci) sono duttili e malleabili, quelli medi ( fra 0.2 e 0.6% di carbonio) possono essere forgiati e saldati e sono usati per elementi strutturali.
Quelli ad alto contenuto di carbonio sono particolarmente duri e sono utilizzati per costruire utensili. Gli acciai inossidabili contengono cromo e nichel (si ricordi il cosiddetto acciaio 18-10 contenente 18% di cromo e 10% di nichel), quelli per utensili che contengono tungsteno, vanadio e cromo. Le proprietà meccaniche di un acciaio non dipendono solo dalla sua composizione chimica, ma anche dai trattamenti termici che esso ha subito.
L’acciaio diventa molto duro e fragile se è riscaldato vicino al punto di fusione e raffreddato rapidamente per immersione in acqua o olio (tempera). La fragilità è attutita mediante il processo di ricottura a temperatura intorno ai 300°C. Questi cambiamenti di proprietà sono legati agli equilibri di fase ferro-carbonio e alla stabilizzazione mediante raffreddamento rapido della fase stabile ad alta temperatura (austenite).
Proprietà
Il ferro puro esiste in tre modificazioni cristalline: a bassa temperatura è stabile la forma α con reticolo cubica a corpo centrato; a 910 °C si ha la forma γ con struttura cubica a facce centrate ; a 1390 °C torna ad essere stabile una forma cubica a corpo centrato, la forma δ ; il ferro fonde a 1535 °C. fino a 768 °C è ferromagnetico ovvero conserva la magnetizzazione anche quando è cessata l’azione del campo magnetizzante.
Il metallo puro è argenteo, duttile e malleabile e si combina con quasi tutti i non metalli a temperature moderate. Si scioglie in acidi non ossidanti dando lo ione Fe2+, mentre in quelli ossidanti dà lo ione Fe3+; in ambiente fortemente ossidante si passiva. I principali stati di ossidazione del ferro sono II e III. Il ferro è un elemento di estrema importanza biologica: è presente infatti nella emoglobina e nella mioglobina oltre che in vari enzimi.
