Il fluoruro di idrogeno è un gas a temperatura ambiente che quando si trova in soluzione acquosa prende il nome di acido fluoridrico.
L’acido fluoridrico è uno dei più semplici acidi inorganici ed ha formula HF. A causa dell’elevata differenza di elettronegatività tra idrogeno e fluoro è una molecola polare con un elevato carattere ionico e un elevato momento dipolare pari a 1.86 D.
In fase vapore il fluoruro di idrogeno oltre gli 80°C è monomerico. A temperature minori si associa in oligomeri e piccoli polimeri anche di tipo ciclico a causa dei legami a idrogeno intermolecolari.
Grazie ai legami a idrogeno il fluoruro di idrogeno ha un punto di ebollizione maggiore rispetto agli altri acidi alogenidrici che, pur avendo un peso molecolare maggiore, non formano legami a idrogeno.
L’acido fluoridrico è un buon solvente delle molecole polari ed è usato sia perché evapora facilmente dai prodotti di reazione sia perché non è un agente ossidante.
Esso non è un buon solvente di sali, ad eccezione dei fluoruri, in quanto non è in grado di solvatare i cationi.
Autoionizzazione
Analogamente all’acqua, l’acido fluoridrico dà luogo ad autoionizzazione secondo la reazione:
2 HF ⇄ H2F+ + H+
con formazione dello ione fluoronio e dello ione fluoruro. Quest’ultimo è a sua volta solvatato da HF per dare una serie di sali tra cui lo ione difluoruro:
F– + HF ⇌ HF2–
L’acido fluoridrico è un acido debole ed è caratterizzato da proprietà particolari che lo differenziano dagli altri acidi. Esso infatti è altamente corrosivo, molto reattivo, pericoloso e incompatibile con molti materiali come il vetro, ceramica, gomma e alcuni metalli.
E’ molto tossico sia per inalazione della forma gassosa sia per contatto con le sue soluzioni acquose.
Sebbene non è infiammabile dalla sua reazione con i metalli si forma H2 che è estremamente infiammabile.
Sintesi
Il fluoruro di idrogeno è ottenuto dalla fluorite minerale contenente il fluoruro di calcio in quantità che va dal 20 all’80%.
A una temperatura di circa 300°C dalla reazione tra fluoruro di calcio e acido solforico si ottengono fluoruro di idrogeno e solfato di calcio:
CaF2 + H2SO4 ⇄ 2 HF + CaSO4
Nell’impianto di produzione è aggiunto acido solforico in modo da spostare verso destra l’equilibrio. Il gas è separato dai solidi e ulteriormente trattato con acido solforico per ottenerlo anidro.
Reazioni
L’acido fluoridrico è utilizzato nella sintesi di fluoroclorocarburi come nel caso della reazione tra tetracloruro di carbonio e fluoruro di idrogeno in presenza di un catalizzatore come il tetracloruro di antimonio:
2 CCl4 + 3 HF → CCl2F2 + CCl3F + 3 HCl
L’acido fluoridrico è una importante materia prima per numerosi prodotti industriali e commerciali. Ad esempio prodotti per la refrigerazione ed in particolare l’1,1,1,2 tetrafluoroetano CH2FCF3 utilizzato per realizzare processi di:
- raffreddamento
- congelamento
- scambio di calore.
Nel settore elettronico, l’acido fluoridrico è sostanza chiave per la produzione di semiconduttori a base di silicio perché è capace di attaccare l’ossido di silicio e di trasformarlo in composti solubili secondo la reazione:
SiO2 + 6 HF → H2SiF6 + 2 H2O
Usi
L’acido fluoridrico e i relativi sali sono utilizzati in diverse fasi della lavorazione di molti metalli, in settori quali la produzione di alluminio ed acciaio inossidabile e le fonderie.
Con il continuo sviluppo di nuovi prodotti e tecnologie, l’utilizzo dell’acido fluoridrico e dei suoi derivati si sta diffondendo sempre più come agenti fondenti, per la riduzione dei punti di fusione, agenti affinanti per i metalli, materiali protettivi per le superfici metalliche prima della rifinitura decorativa.
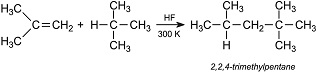
L’acido fluoridrico trova impiego quale catalizzatore nell’ambito dell’industria petrolchimica nelle reazioni di alchilazione per la produzione di benzine ad elevato numero di ottani.
Nel processo le frazioni a basso punto di ebollizione come il 2-metilpropene vengono fatte reagire con l’isobutano per generare gli alchilati ramificati come il 2,2,4,-trimetilpentano:
Dall’acido fluoridrico si possono ottenere i monomeri di partenza di fluoropolimeri come il politetrafluoroetilene dotati di incombustibilità, resistenza meccanica, isolamento, bassa tensione superficiale e resistenza alle sostanze chimiche.
Un settore in espansione nell’ambito della ricerca scientifica è quello degli organofluoruri: un solo atomo di fluoro presente in una molecola organica può infatti modificare o incrementare l’azione di molecole complesse tra cui insetticidi, erbicidi e farmaci.